Biology

S + E ? SE ? SE++ ? P + E
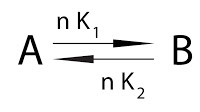
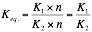
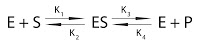
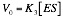
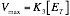
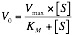
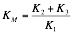
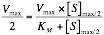 Por lo tanto:
Por lo tanto: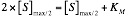 Y al final obtendríamos que:
Y al final obtendríamos que: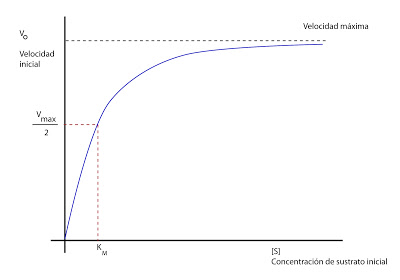
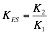
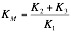 Pero como K2 >> K3 podremos despreciar K3 y por lo tanto:
Pero como K2 >> K3 podremos despreciar K3 y por lo tanto: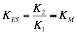 Se trata de una medida de la afinidad del enzima por el sustrato. Valores altos de estas constantes de equilibrio equivalen a decir que el sustrato y el enzima no son muy afines. Valores muy bajos, en cambio, equivalen a decir que el complejo se disocia con dificultad, es decir, que son muy afines.
Se trata de una medida de la afinidad del enzima por el sustrato. Valores altos de estas constantes de equilibrio equivalen a decir que el sustrato y el enzima no son muy afines. Valores muy bajos, en cambio, equivalen a decir que el complejo se disocia con dificultad, es decir, que son muy afines.
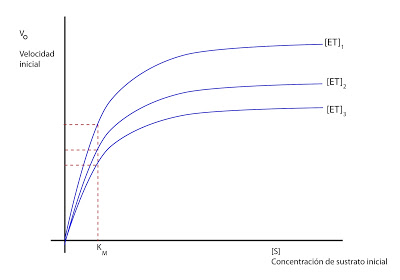
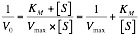 Podremos realizar la siguiente representación gráfica, que es más exacta que la de Michaelis-Menden a la hora de calcular KM y Vmax.
Podremos realizar la siguiente representación gráfica, que es más exacta que la de Michaelis-Menden a la hora de calcular KM y Vmax.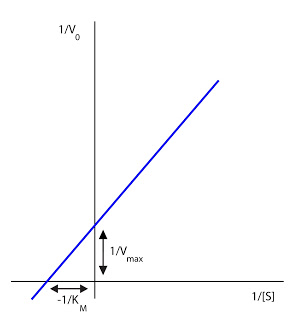 Si un enzima trabaja sobre tres productos a la vez, podrían existir varias y se complicaría un poco el caso.
Si un enzima trabaja sobre tres productos a la vez, podrían existir varias y se complicaría un poco el caso.
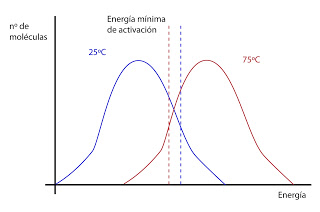
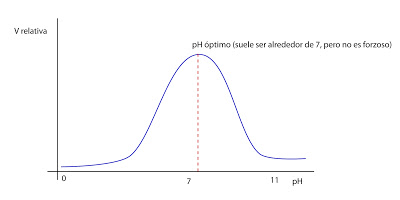 Otro factor que influye en la velocidad de reacción es la temperatura, que aumenta la velocidad de reacción en ausencia de enzima. Aproximadamente, sin enzima, cada 10ºC se duplica la velocidad de reacción. Pero cuando hay enzimas, a temperaturas elevadas, generalmente por encima de 40ºC, el calor comenzará a desnaturalizar al enzima. Es una situación que nunca se dará dentro de la célula.
Otro factor que influye en la velocidad de reacción es la temperatura, que aumenta la velocidad de reacción en ausencia de enzima. Aproximadamente, sin enzima, cada 10ºC se duplica la velocidad de reacción. Pero cuando hay enzimas, a temperaturas elevadas, generalmente por encima de 40ºC, el calor comenzará a desnaturalizar al enzima. Es una situación que nunca se dará dentro de la célula. Todo esto explica cómo actúa el enzima fuera de la célula. Dentro de la célula hay varias incógnitas. En las células el funcionamiento del enzima está influenciado por cómo están organizados los sistemas multienzimáticos, ya que en es el conjunto de todos ellos los que catalizan una ruta metabólica.
Todo esto explica cómo actúa el enzima fuera de la célula. Dentro de la célula hay varias incógnitas. En las células el funcionamiento del enzima está influenciado por cómo están organizados los sistemas multienzimáticos, ya que en es el conjunto de todos ellos los que catalizan una ruta metabólica.
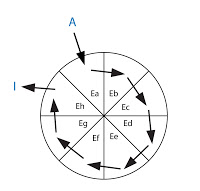
 Antes de actuar como sustrato de otra reacción, debe encontrarse con su enzima correspondiente. Se ha perdido un tiempo de difusión. La velocidad total de la ruta se va a ver limitada por esa velocidad de difusión entre un enzima y otro. A mayor concentración de los sustratos o de los enzimas, aumentará la velocidad de reacción. Lo que pasa es que la célula tiene una capacidad limitada. Para aumentar la velocidad sin aumentar la concentración de sustrato o enzimas se van a seguir una serie de estrategias:
Antes de actuar como sustrato de otra reacción, debe encontrarse con su enzima correspondiente. Se ha perdido un tiempo de difusión. La velocidad total de la ruta se va a ver limitada por esa velocidad de difusión entre un enzima y otro. A mayor concentración de los sustratos o de los enzimas, aumentará la velocidad de reacción. Lo que pasa es que la célula tiene una capacidad limitada. Para aumentar la velocidad sin aumentar la concentración de sustrato o enzimas se van a seguir una serie de estrategias:
- Fotosíntesis
Introducción. La energía de la luz acaba transformándose en la energía de los compuestos orgánicos. Estos serán utilizados como hemos visto en temas anteriores, bien directamente o indirectamente mediante cadenas trópicas. La energía de la luz...
- Ribosomas: El Proceso De Traducción
Traducción. Hasta ahora hemos visto el paso de ADN a ARN. El paso que estudiaremos ahora es el paso de ARN a polipéptidos, es decir, pasar de una secuencia de nucleótidos, una información lineal, a ua secuencia de aminoácidos que conformarán una...
- Tránsito De Energía En La Célula: Atp Y Nadh
Todos los procesos metabólicos que hemos estudiado, hemos mencionado varios tipos de sistemas de transferencia de energía. Vamos a analizar las moléculas usadas por los organismos para mediar en estas transferencias. Unas de ellas aprovecharán...
- Meabolismo: Reducción Anaeróbica Y Ciclo De Krebs
En una entrada anterior analizábamos las primeras fases de la reducción de la glucosa, mediante el proceso denominado glucolisis y que producía ácido pirúvico. En esta entrada analizaremos las dos rutas más importantes que sigue el ácido pirúvico....
- Transporte A Través De Membrana
Transporte por difusión física simple. Es un transporte pasivo y no mediado. La membrana debe ser permeable para el producto en cuestión, que pasará desde la zona más concentrada a la zona más diluida. En teoría, cualquier molécula se puede disolver...
Biology
Enzimas: energía de activación
Los enzimas son los catalizadores de las células. Sin ellos, la vida sería imposible, pues no se podría vivir a la temperatura y presión que en teoría serían necesarias para que las reacciones se produjeran.
Los enzimas no se consumen. Tienen dos propiedades:
- Poder catalítico: dispara las reacciones químicas, hasta incluso un millón de veces más deprisa.
- Especificidad: respecto del sustrato o ligando y en cuanto a la transformación que cataliza.

Dentro de una célula habrá cientos de enzimas distintos. La especificidad hace que dentro de un mismo compartimento puedan tener lugar, a la vez, cientos de reacciones distintas sin que se confundan.
Por otro lado, algunos enzimas tienen también capacidad reguladora.
En cuanto a su nomenclatura, tiene que incluir el nombre del sustrato y el tipo de transformación. Suele acabar en el sufijo -asa, indicando en la primera parte del nombre el sustrato seguido de la función. Por ejemplo, isocitrato deshidrogenasa.
Si en su nombre solo aparece el sustrato seguido del sufijo -asa es que su función es la hidrólisis. Por ejemplo, las proteasas hidrolizan proteínas.
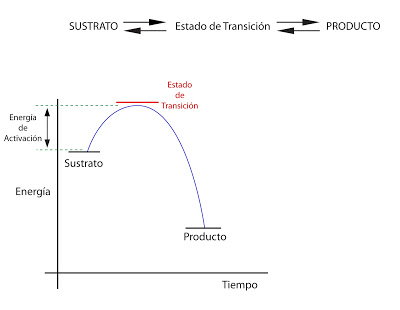
Energía de activación.
Sería la cantidad de energía que habría que aplicar a un sustrato para que comience la reacción.

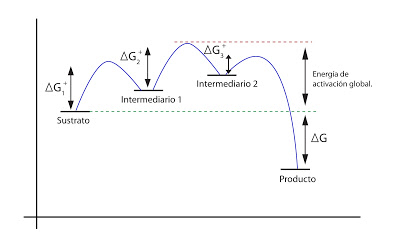
Hay muchas reacciones con un ?G < 0 y que no tienen lugar o tienen lugar a velocidades muy bajas. Se debe a la falta de energía de activación. Estos sustratos deben pasar la barrera energética para poder transformarse en productos.
La energía de activación ?G++ es la energía necesaria para llevar al sustrato hasta el estado de transición a una temperatura determinada.
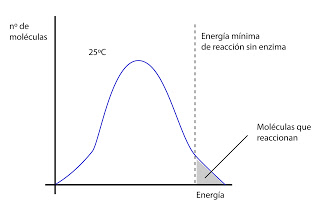
En una solución no todas pueden llegar al estado de transición, ya que por los propios movimientos al azar de las moléculas, no todas estarán a la misma energía. Solo las que tengan un nivel energético más alto podrán transformarse. La velocidad de reacción es proporcional a las moléculas en estado de transición.

Un método para aumentar la velocidad de reacción es aumentar la temperatura o la presión. Pero estos métodos no serían viables en las células.

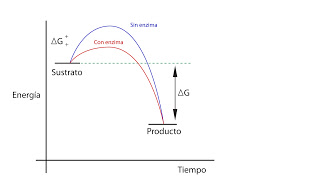
Los enzimas aumentan la velocidad de reacción. En vez de aumentar la energía de las moléculas, lo que hacemos es rebajar la energía de activación. El enzima reacciona con el sustrato, formando un complejo enzima - sustrato que tiene un estado de transición de energía más baja. Tiene una mayor probabilidad de formarse. Por lo tanto, se aumenta la velocidad de reacción:
S + E ? SE ? SE++ ? P + E
Donde S es el sustrato, E el enzima, SE el complejo enzima - sustrato y P el producto.
El ?G depende del punto de partida y de llegada, no de los pasos intermedios. Por eso, ?G es constante para una reacción determinada.

Los enzimas no varían la constante de equilibrio K, ya que aceleran la reacción en ambos sentidos. Multiplican por un número los dos factores de la ecuación. Lo que ocurre es que se llega al equilibrio a mayor velocidad:
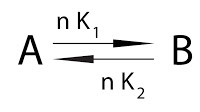
De forma que:
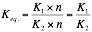

Para que la reacción tenga lugar, debe superarse la energía de transición de mayor energía.
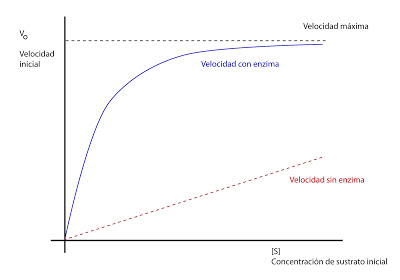
Para la mayoría de los enzimas, la velocidad de reacción se va a modificar en función de la concentración según esta curva (para una concentración de enzima constante):

Llega un punto en que se alcanza la velocidad máxima, en la cual, por más que aumentemos la concentración de sustrato inicial, la velocidad no aumenta. Habría que aumentar la concentración de enzima para que la velocidad aumentase.
Esto se explica por la teoría de Michaelis, que dice que el enzima se combina con el sustrato, dando lugar a un intermediario sustrato - enzima produciéndose de ese modo la reacción. Hay una cantidad de intermediario sustrato - enzima máximo. En cuanto todo el enzima que teníamos se satura, ya no puede capturar más y no puede aumentar más la velocidad. Es el momento en el que la velocidad es máxima y estamos en el estado de saturación del enzima. La ecuación de Michaelis - Menten sería:
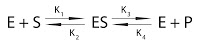
Se llega a la saturación cuando la concentración total de enzima es igual a la concentración de enzima y sustrato unidos: [ET] = [ES].
La primera parte de la reacción es más rápida. la segunda parte es más lenta y por lo tanto la que va a determinar la velocidad de reacción.
Consideramos que al principio de la reacción es mucho K3 menor que K4 y por lo tanto podemos desperdiciar K4. La segunda reacción quedaría establecida en un solo sentido: ES ? E + P, siendo su constante K3. Por lo tanto la ecuación que nos da la velocidad de reacción sería:
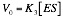
A K3 se le denomina número de recambio o constante catalítica. Corresponde al número máximo de moléculas de sustrato transformadas en producto por un enzima por unidad de tiempo. Por eso se habla de Kcat.
Cuando el enzima trabaja a pleno rendimiento, [ES] = [ET]. En esas circunstancias, V0 = Vmax y por lo tanto tendremos la ecuación:
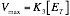
Si la relación entre [ES] y [ET] fuese distinta al 100%, no obtendríamos la velocidad máxima, sino ese mismo porcentaje de la velocidad máxima. Por ejemplo, si l relación fuese el 30% la velocidad obtenida sería el 30% de la velocidad máxima.
Michaelis-Menten llegaron a la siguiente fórmula:
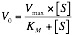
Donde KM es la concentración de S para que V sea la mitad de la máxima, es decir:
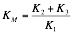
Y de esta forma, ya que la V es la mitad de la máxima:
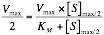
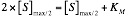
Km = [S]max/s Expresado en mol/l

Cada enzima posee una KM constante. Y como cada enzima es específico par aun sustrato, tenemos la constante para la reacción concreta.
La KM es constante para la concentración de enzima total:

La constante de disociación del enzima al sustrato KES, (K2 / K1), es igual que KM:
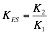
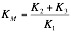
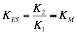
Podremos también deducir la ecuación de Linewaner-Burk:
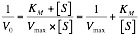

El pH afecta al enzima y al sustrato. La mayoría de los enzimas solo serán eficaces a un cierto valor de pH:


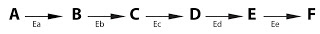
Esto sería un ejemplo de ruta metabólica con enzimas:

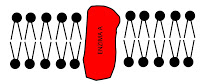
- Agrupar todos enzimas de un sistema multienzimático en un complejo multienzimático. De esta forma, el producto es transferido directamente al siguiente enzima, de manera que en el complejo entra, por ejemplo, un sustrato A y sale directamente el sustrato I. La velocidad total no estará influenciada por la velocidad de difusión, aumentando la eficacia.

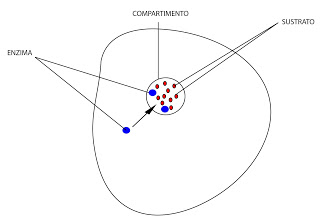
- Encerrar todos los enzimas y sustratos o metabolitos intermediarios de la ruta en un compartimento.

- El complejo multienzimático se encuentra incluido en una membrana. Se reduce la difusión de un espacio tridimensional a un espacio bidimensional. La probabilidad de que el sustrato y el enzima se encuentren es mucho mayor en dos dimensiones que en tres dimensiones.

- Fotosíntesis
Introducción. La energía de la luz acaba transformándose en la energía de los compuestos orgánicos. Estos serán utilizados como hemos visto en temas anteriores, bien directamente o indirectamente mediante cadenas trópicas. La energía de la luz...
- Ribosomas: El Proceso De Traducción
Traducción. Hasta ahora hemos visto el paso de ADN a ARN. El paso que estudiaremos ahora es el paso de ARN a polipéptidos, es decir, pasar de una secuencia de nucleótidos, una información lineal, a ua secuencia de aminoácidos que conformarán una...
- Tránsito De Energía En La Célula: Atp Y Nadh
Todos los procesos metabólicos que hemos estudiado, hemos mencionado varios tipos de sistemas de transferencia de energía. Vamos a analizar las moléculas usadas por los organismos para mediar en estas transferencias. Unas de ellas aprovecharán...
- Meabolismo: Reducción Anaeróbica Y Ciclo De Krebs
En una entrada anterior analizábamos las primeras fases de la reducción de la glucosa, mediante el proceso denominado glucolisis y que producía ácido pirúvico. En esta entrada analizaremos las dos rutas más importantes que sigue el ácido pirúvico....
- Transporte A Través De Membrana
Transporte por difusión física simple. Es un transporte pasivo y no mediado. La membrana debe ser permeable para el producto en cuestión, que pasará desde la zona más concentrada a la zona más diluida. En teoría, cualquier molécula se puede disolver...
